近年の主な研究課題は、以下の通りです。
- 有機触媒を用いた新規不斉反応の開発
- 水の凝固による高圧を利用した有機合成
- 生物学的に重要な分子の全合成
1) 有機触媒を用いた新規不斉反応の開発
不斉触媒反応は、現代有機合成化学において非常に重要な研究課題です。 当研究室では、取り扱い容易なプロリン触媒を用いた2つの高エナンチオ選択的合成法を発見しました。
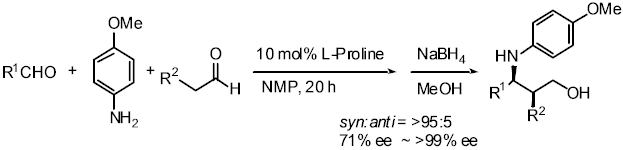
アルデヒドのエナンチオ選択的ワンポット3成分交差Mannich反応:
2つの異なるアルデヒドの片方をMannichドナー、もう片方をMannichアクセプターとして立体選択的ワンポット3成分交差Mannich反応により、
β−アミノアルデヒドをsyn-選択的、かつエナンチオ選択的に得る方法を開発しました。
プロリン触媒によるアルデヒドおよびケトンの触媒的不斉α−アミノオキシ化:
アルデヒドおよびケトンを触媒量のプロリン存在下、ニトロソベンゼンと反応させるとカルボニルのα−アミノオキシ化が高収率かつ高エナンチオ選択的に起こります。
生成物のα−アミノオキシアルデヒドおよびケトンは、合成化学的に重要な構造であるα−ヒドロキシアルデヒドおよびケトンへと簡単に誘導できます。
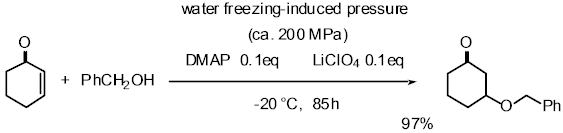
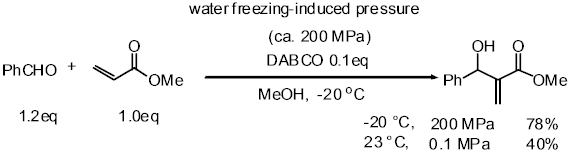
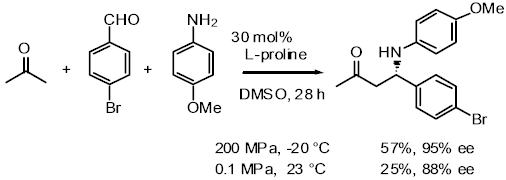
2) 水の凝固による高圧を利用した有機合成
圧力は有機反応を加速させる上で重要な役割を担います。水の体積は凍ることで1割増加しますが、封管中で凍らせることで圧力を200MPaまで上昇させることに成功しました。
私たちはこの高圧をMichael付加反応、Baylis-Hilman反応、プロリン触媒によるMannich反応およびアルドール反応などの有機合成反応に適用しました。
その中でも特に、プロリン触媒によるMannich反応では、常圧条件下よりも良い収率と高いエナンチオ選択性でMannich付加体が得られました。
3) 生物学的に重要な分子の全合成
興味深い生物活性を有する分子は天然に多く存在しますが、希少な天然物の場合、量的供給が難しくてそれらの生物学的研究を進めることができません。 化学合成はそうした天然物の量的供給を可能にする良い方法です。当研究室では、独創的手法に基づき、複雑でユニークな分子構造を持つ希少天然物の全合成研究をしています。
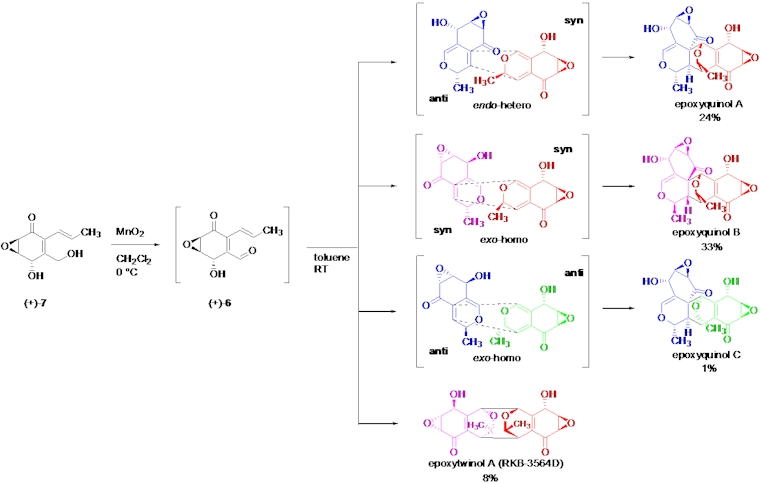
血管新生阻害物質は、ガンを含む血管新生に関わる病気の治療薬として期待されています。 エポキシキノールAおよびBは抗血管新生作用を有するユニークなペンタケチドダイマーです。 非常に官能基化され複雑な7環性骨格に12個の不斉中心を持っていますが、 より簡単な構造であるエポキシシクロへキセノンの酸化的二量化により生合成されていると考えられています。 私たちは生合成仮説に基づく酸化的二量化反応により、天然物である(+)-エポキシキノールAおよびBについて 絶対立体配置の決定とともに、初の全合成を達成しました。
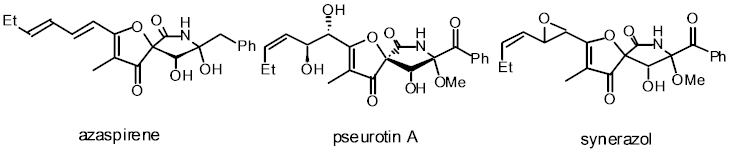
アザスピレンは、高度に酸化された1-オキサ-7-アザスピロ[4,4]ノネン-4,6-ジオン骨格にベンジル基とヘキサジエン部を有する新規血管新生阻害剤です。
当研究室は(-)-アザスピレンの全合成の達成と絶対配置の決定に成功しました。 MgBr2・OEt2を用いるジアステレオ選択的向山アルドール反応と、NaHによるアルキニルアミドへの分子内環化反応、
アミドや3級アルコールなど、官能基化されたγ−ラクタム部を有するケトンへのアルドール反応を鍵反応として用いています。 また私たちは類似法によりセウロチンAの初の全合成も達成しています。
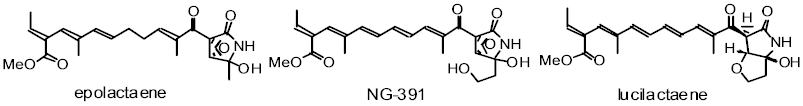
エポラクタエンは、神経突起伸長を促進し、ヒト神経芽腫細胞株中のG1期で細胞周期を停止するのに有効である微生物の代謝物質であり、 そのためエポラクタエンは認知症などの神経疾患の治療薬になるのではないかと期待されています。 私たちは、テトラヒドロピラン-2-オールから(+),(-)-エポラクタエンの両方のエナンチオマーの立体選択的全合成を達成しました。 重要な反応は以下のとおりです。
1) 速度論的プロトン脱離および熱力学的平衡を組み合わせた、共役(E,E,E)トリエンの立体選択的構築。
2) β-ケトニトリルとキラルな2-アルコキシアルデヒドの(E)選択的なKnoevenagel縮合。
3) 嵩高い求核剤(TrOOLi)および適切な保護基を使用して達成された立体選択的なエポキシ化。
4) 水酸基を媒介にし、分子内で作用することによって促進されたTLC上でのシリカゲルによるα−エポキニトリルの穏やかな加水分解。
さらに私たちは、独自の方法論によって、神経栄養活性および神経突起伸長に影響を及ぼすNG-391を合成しました。
|